- ホーム
- 臨床研究審査委員会について
- 疾病・不具合・不適合報告
臨床研究審査委員会について
疾病・不具合・不適合報告
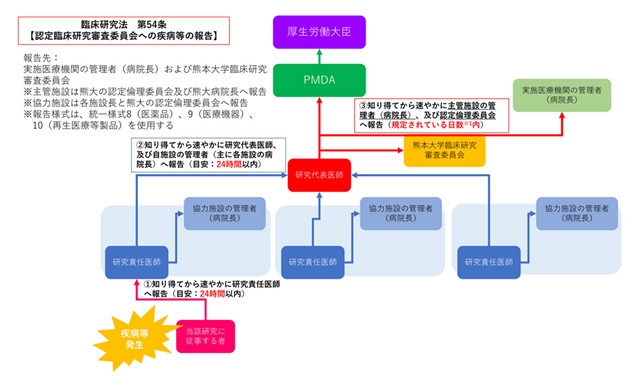
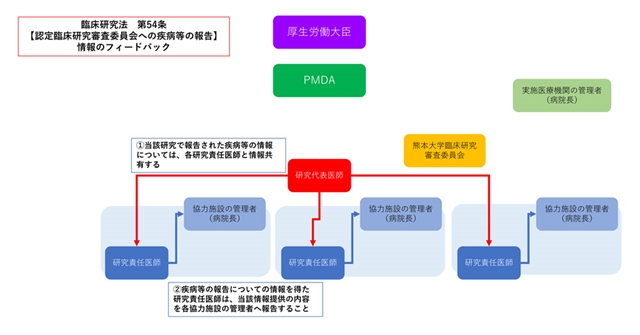
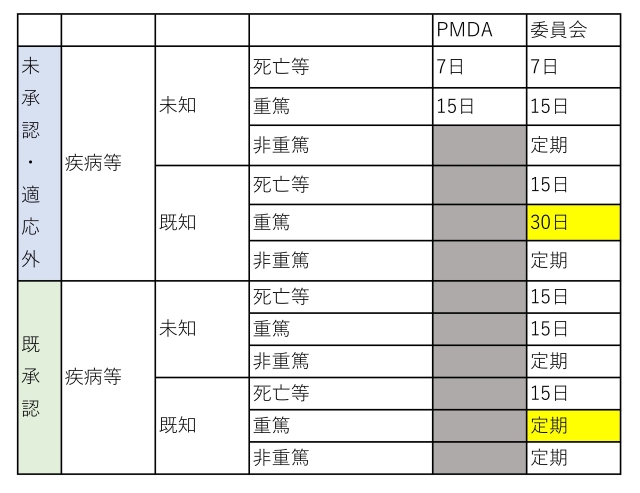
特定臨床研究の実施する研究責任医師は、疾病等及び不具合の発生を知ったときは、定められた期間内に病院長及び熊本大学臨床研究審査委員会に報告しなければなりません。
- 特定臨床研究等における疾病・不具合等の取扱いに関する手順書 (PDF:295KB)
病院長報告様式
- 疾病・不具合等病院長報告(他施設で発生) (Word:31KB)
- 疾病・不具合等病院長報告(本院で発生) (Word:29KB)
- 不適合病院長報告(他施設で発生) (Word:30KB)
- 不適合病院長報告(本院で発生) (Word:29KB)